一、实验目的
1. 初步掌握用差速离心法分离大鼠肝细胞线粒体的方法。
2. 学习并掌握高速离心机和匀浆器的使用方法。
二、实验原理
线粒体(mitochondria)是真核细胞中产生能量的重要细胞器。细胞中的能源物质—脂肪、糖、部分氨基酸在此进行最终的氧化,并通过偶联磷酸化生成ATP,供给细胞生理活动之需。对线粒体结构与功能的研究通常是在离体的线粒体上进行的。
制备线粒体时,可将组织匀浆液悬浮在悬浮介质中进行差速离心法进行分离。在一定的离心场中(选用离心机的一定转速),大小不一的颗粒沉降速度取决于它的密度、半径和悬浮介质的粘度。在一个均匀悬浮介质中离心一定时间,组织匀浆中的各种细胞器及其它内含物由于沉降速度不同而停留在高低不同的位置。依次增加离心力和离心时间,就能够使这些颗粒按其大小、轻重分批沉降在离心管底部,从而分批收集。细胞器中最先沉淀的是细胞核,其次是线粒体,其它更轻的细胞器和大分子可依次再分离。
悬浮介质通常用缓冲的蔗糖溶液,它比较接近细胞质的分散相,在—定程度上能保持细胞器的结构和酶的活性,在pH7.2 的条件下,亚细胞组分不容易重新聚集,有利于分离。整个操作过程应注意使样品保持4℃,避免酶失活。
线粒体的鉴定用詹纳斯绿活染法。
三、实验用品
(一) 材料 小鼠12 只
(二)器材 冷冻高速离心机、解剖刀剪、小烧杯、冰浴、漏斗、尼龙网、玻璃匀浆器、PH 计、高压灭菌锅等。
(三)试剂 氯化钠、詹纳斯绿B、盐酸、三羟甲基氨基甲烷(Tris)、D(十)蔗糖、甲醇、冰醋酸、双蒸水、甘油、姬姆萨染料、KH2P04 、Na2HP04。
1.0.9%灭菌的生理盐水。
2. 1%詹纳斯绿B 染液,用0.9%灭菌的生理盐水配制。
3. 0.25mol/L 蔗糖十0.01mo1/L Tris-盐酸缓冲液(pH7.4):
0.1mol/L 三羟甲基氨基甲烷(Tris) 10ml
0.1mol/L 盐酸8.4ml
加重蒸水到100ml
加蔗糖到0.25mol/L。
4. 0.34mol/L 蔗糖十0.01mol/L tris-盐酸缓冲液(pH7.4)
5. 固定液:甲醇:冰醋酸(9:1)
6. 姬姆萨染液(原液):Giemsa 粉0.5g,甘油33m1,纯甲醇33m1。先将Giemsa 粉置于研钵内中,加少量甘油研磨至无颗粒,再将剩余甘油倒入混匀,56℃左右保温2h 令其充分溶解,最后加甲醇混匀,成为姬姆萨原液,保存于棕色瓶。
7. 姬姆萨染液(应用液):临用时,吸出1ml 原液,用9ml 1/15mol/L 磷酸盐缓冲液(PBS)作l0 倍稀释。
8. 1/15mol/L 磷酸盐缓冲液(pH6.8):
l/15mol/L KH2P04 50ml
l/15 mol/L Na2HP04 50ml
四、实验操作
1. 制备小鼠肝细胞匀浆实验前小鼠空腹12h,拉颈处死,剖腹取肝,迅速用生理盐水洗净血水,用滤纸吸干。称取肝组织2g,剪碎,用预冷到0~4℃的0.25mol/L 缓冲蔗糖溶液洗涤数次。然后在0~4℃条件下,按每克肝加9ml冷的0.25mol/L 缓冲蔗糖溶液将肝组织匀浆化,蔗糖溶液应分数次添加。匀浆液用200 目铜筛过滤备用。
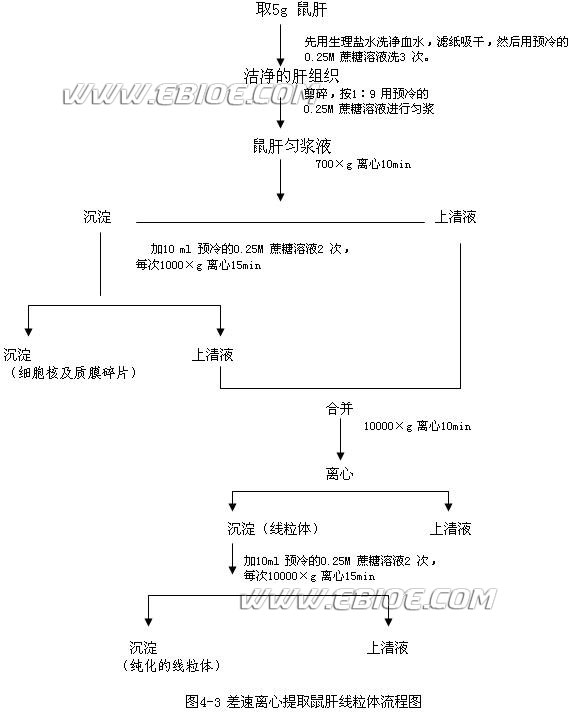
2. 离心先将9ml 0.34mol/L 缓冲蔗糖溶液放入离心管,然后沿管壁小心地加入9ml 肝匀匀浆使其覆盖于上层。用冷冻高速离心机按图图4-3 顺序进行差速离心。差速离心提取鼠肝线粒体流程见图4-3。
3. 分离物鉴定
(1) 细胞核取细胞核沉淀1 滴涂片,入甲醇-冰醋酸液固定15min,充分吹干,滴1 滴姬姆萨染液应用液染色10min。自来水冲洗,吹干,镜检。结果:细胞核呈紫红色,上面附着的少量胞质及浅蓝色碎片。
(2) 线粒体取线粒体沉淀1 滴涂片,滴加1%詹纳斯绿B 染液染20min,覆上盖玻片,镜检。线粒体蓝绿色,呈小棒状或哑铃状。
五、实验建议
1. 注意尽可能先充分剪碎肝组织,缩短匀浆时间,整个分离过程不宜过长,以保持组分生理活性。最好在在0~4℃或冰浴中进行。
2. 将匀浆液置于蔗糖溶液上层时要沿管壁小心加入,同时及时离心,以防匀浆液中的颗粒自然下沉过快,影响后面的离心分层效果。
3. 姬姆萨染液应用液要在实验时临时配制,效果较好。过期的应用液不可使用。